- 1 ống thủy tinh (Acrylic) trong suốt được chia thành các vạch có thể tích từ 0 đến 270cm.
- Đường kính trong: 4,5cm
- Ống thủy tinh được bịt kín 1 đầu, đầu kia có gắn với đồng hồ đo áp suất và có van xả.
- Thay đổi thể tích bằng 1 núm vặn trơn tru.
- Thiết bị được thiết kế chắc chắn, chính xác

Bộ thí nghiệm Boyle – Mariotte

Bộ thí nghiệm Boyle – Mariotte

Bộ thí nghiệm Boyle – Mariotte: Đồng hồ áp suất và van khí

Bộ thí nghiệm Boyle – Mariotte: Pittong
Mục đích:
Nghiệm lại định luật Boyle Mariotte về khí lý tưởng.
Các bước tiến hành:
Cơ sở lý thuyết:
Với 1 lượng khí không đổi (Lưu ý van khí phải đóng, thiết bị phải chuẩn vì thiết bị lởm thì lượng khí trong ống sẽ thoát ra ngoài khi áp suất tăng lên, lúc đó lại đổ cho ông Bôi và ông Rốt sai) thể tích sẽ phụ thuộc vào áp suất và nhiệt độ khí đó.
Nếu nhiệt độ không đổi, thì tích giữa thể tích và áp suất có 1 giá trị không đổi
P.V = không đổi. (1)
Định luật này được khám phá bởi hai ông: Boyle – Mariotte cho khí lý tưởng (0oC và 1 atm hay 10kPa).
Cái mà hai ông khám phá ra nó là trường hợp đặc biệt của một định luật chung cho chất khí lý tưởng. Mô tả cho định luật chung này là một phương trình trạng thái:
P.V = n.R.T (2)
Trong đó R = 8.314 J/Mol.K gọi là hằng số khí
n là số mol của khối khí (của khối khí trong ống thí nghiệm). Đại lượng này phụ thuộc vào lượng khí ban đầu V0.
Tiến hành thí nghiệm:
Lưu ý: Làm chậm chậm thôi, không phải để câu giờ mà để sao cho nhiệt độ trong ống thí nghiệm không tăng.
Lưu ý: Đường kính ống: 4,5cm, mỗi vạch cách nhau 1cm.
Nhiệt độ phòng: 260C = 299K
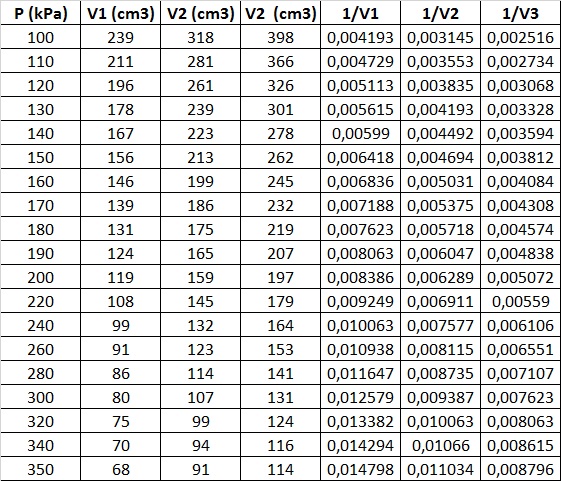
Vẽ đồ thị:

Nhìn vào đồ thị này thì không thể biết ông Boyle-Mariotte đúng hay sai.
Nó cứ cong cong như cái đuôi con gà thế này thì không biết nó theo quy luật nào.
Theo hai ông thì P.V = hằng số. Vậy V tỷ lệ nghịch với P.
Vậy P tỷ lệ thuận với 1/V. Vậy nếu ta vẽ đường P ~ 1/V thì nó phải là đường thẳng.
Ta thử vẽ xem nhé.

Quá là thẳng luôn. Kết luận thôi: abcxyz
Ta có thể dự vào phương trình (2) để tính số mol không khí.
Với V0 = 239cm3: Tích p.V trung bình = 2364, T = 299K, R = 8.314J/Mol.K, n = 0,95
Với V0 = 318cm3: Tích p.V trung bình = 3165, T = 299K, R = 8.314J/Mol.K, n = 1,27
Với V0 = 398cm3: Tích p.V trung bình = 3943, T = 299K, R = 8.314J/Mol.K, n = 1,59
Tính sai bét hết rồi. Sao lại sai nhỉ?
Đổi đơn vị sang m3, áp suất sang Pa nhanh. ahihi.
Với V0 = 0.000239m3: Tích p.V trung bình = 23,64, T = 299K, R = 8.314J/Mol.K, n = 9,5mMol
Với V0 = 0.000318cm3: Tích p.V trung bình = 31,65, T = 299K, R = 8.314J/Mol.K, n = 12,7mMol
Với V0 = 0.000398cm3: Tích p.V trung bình = 39,43, T = 299K, R = 8.314J/Mol.K, n = 15,9mMol